細胞内のタンパク質構造を、「揺らぎ」の側面から解明する。
楯先生は、生命の根源を理解しようとする「生物物理学」のオーソリティである。なかでも先生が扱うのは分子レベル、とりわけ、細胞内のタンパク質を研究対象としている。
「興味の中心は、分子を通して生命を理解したいということ。でき得るならば、生命現象を物理や数学のことばで記述したい、理解したいという思いが、ぼくの研究のモチベーションです」と先生は言う。
先生は、分子が持っている物理的な特性や動き、形の変化といったものが、生命現象の制御にどのように関わっているかを解明しようとする研究をおこなっており、学生時代から学んできたNMR(核磁気共鳴)という方法を武器としている。
タンパク質は特定の立体構造になっており、その立体構造が、分子の機能発現に重要であるということはよく知られているが、2003年にヒトゲノムの解読終了が宣言されると、網羅的ゲノム解析の結果から、哺乳動物のタンパク質の50%は、安定的な立体構造を保持しない天然変性領域(ID領域)であることが分かってきた。「つまりそれは、過去70年の構造生物学の歴史が実は、タンパク質という分子の、片側の側面しか見てこなかったということを意味するんですよ」と先生。そこで、残る50%、タンパク質の形がない部分はどのような構造と機能を持っているのか、構造解析とそれに基づく機能解析が注目されるようになり、いまや世界中の研究者の関心はそこにある。楯先生もまた、タンパク質構造の揺らぎが持つ機能上の役割の解明を目指し、特に、ID領域が持つ新たな機能の解明を中心に研究を進めている。特徴的なのは、新規構造解析技術の開発を基盤として、新たなタンパク質構造研究を独自に進めている点だ。
「NMRは溶液の中のタンパク質の構造を決められる点に特徴があるけれども、一方であまり大きな分子は扱えない。薬の標的になるようなタンパク質は、NMRで構造解析できる分子量限界である30kDaを超えてしまっているんでね。そこにはどうしても新しい技術開発が必要になる。そこでぼく達は、そうした高分子量タンパク質を対象として、タンパク質が機能する際に発現する分子形態変化を定量的かつ高感度で観測するNMR技術の開発を進めた訳です」。
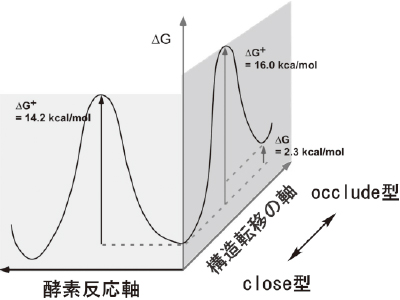 DHFRの活性ループ構造の二つの時間域での揺らぎと酵素反応制御
DHFRの活性ループ構造の二つの時間域での揺らぎと酵素反応制御

 AVANCE 700MHzデジタルNMR装置
AVANCE 700MHzデジタルNMR装置
高分子量タンパク質の分子形態変化を観測するNMR技術開発に成功。
先生は新たな計測技術をDIORITE(Determination by Induced ORIentation by Trosy Experiments)と名付けた。DIORITE法では、通常のNMRでは使われない「異方性スピン相互作用」を利用する。そして、高分子量タンパク質でも高感度で観測できるTrosy(Transverse Relaxation Optimazed Spectroscopy)シグナルの磁場配向依存的変化から分子配向テンソルを決定することにより、分子量限界を克服したという。(※1)
「平たく言うと、タンパク質の形を持っている部分については、X線結晶構造解析によって解かれていて、プロテインデータバンクに立体構造情報が膨大に蓄積されている。しかし、タンパク質の形を持たない部分、安定的な立体構造を保持しない部分では実は、かたまりがビーズ状につながっていることがあって、そのかたまり同士が空間的にどうやって向きを変えるのかというのが非常に重要なんだけれども、その解析が非常に難しかった。DIORITE法というのは、そのビーズ状につながったかたまり同士の空間的な位置がどう変化するか、そこに薬がからむとどう向きが変わるかというのを、きわめて正確に解析するNMR技術を使った計測技術なんです」と楯先生。
同じく先生の研究グループが開発した、さまざまなタンパク質に対して最適な磁場配向状態を作る試料調整技術などを駆使して、最適なコンディションさえうまく作ってやれば、実用上、十分な解析精度を発揮する技術であることが検証実験によっても証明されている。画期的なこのDIORITE法は現在、国内および国際特許をすでに出願済みである。
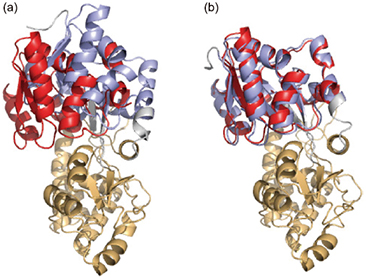 DIORITE法で決定したマルトース結合型MBPのNドメインの配向(赤)、
DIORITE法で決定したマルトース結合型MBPのNドメインの配向(赤)、(a)Apo型MBP結晶構造(PDB: 1OMP)(青),
(b)マルトース結合型MBP結晶構造(PDB: 1ANF)(青)との比較

どこにも負けないデータを保持し、核内クロマチン構造・動態の可視化にも挑む。
さらに、「ぼくらには、他には絶対負けないアドバンテージが1つあるんです」と先生。それは、2012年に文部科学省に採択された事業で、広島大学に設置された研究拠点「クロマチン動態数理研究拠点」でおこなわれた研究の成果として、他にはないようなデータを豊富に持っていることである。
「ぼくらは分裂酵母の中の133か所の遺伝子座に蛍光標識を入れて、その蛍光標識の核内の動きの何万点ものデータを全部持っていてデータベースにしている。世界でも他に持っているひとがいないような、どこにも負けないデータを持っているという自信があるんですよ」。
このデータを使って、電子顕微鏡像を解釈すれば、実験データに基づいてクロマチン構造のモデルをつくる、いわゆる「データドリブンモデル」を作ることが可能になる。これに数理モデルというアプローチも加えることで、これも先生が長く取り組んでいる研究テーマのひとつである「核内クロマチン構造・動態の可視化」に大きく近づくことができると先生は言う。
「クロマチン動態数理研究拠点」には、細胞生物学・分子生物学を専門とする実験系の研究者と、計測データをもとに数理モデルを構築し物理的機構の解析を進める数理科学系の研究者が集まり、緊密な連携のもとにさまざまな融合領域研究を行っており、その枠組みはいまも健在だ。
「規模の大きな研究グループで、規模の大きな研究をやるということが先端研究につながってくる。いまいちばん知らなきゃいけない問題はどこのあるのかということをシャープに考えると、やはりひとりでやるのは絶対無理で、大勢の研究者を巻き込むようなチーム研究になってくる」。


楯先生の研究への想いはぶれることはないが、手法や研究対象はこうした理由で、どんどん変化しているのだという。新しいNMR技術についても、先生は、「ぼくにとってはもうすでに過去の技術」と言い、「いまは電子顕微鏡でどこまでいけるかというのが興味の中心」と前を向く。
その想いは研究室にも反映されている。現在、研究室の半分ではNMRでの研究が、もう半分では電子顕微鏡での研究が行われており、学生たちは、電子顕微鏡のサンプルづくりを身につけるために、NIH(アメリカ国立衛生研究所)やソウル大学等に数か月派遣されることもあるという。
今後の研究はどこまで進んでいくのだろう。最後に展望を明かしてもらった。
「短期的な目標としては、核内クロマチン構造を完璧に可視化するということ。染色体がどういう風に形を変えて、遺伝子制御や細胞の分化、外からの刺激への応答などにどのように関わっているのかをちゃんと理解したいし、できればモデル化まで持っていけたらひと区切りかなぁと思っています。ぼくが退職を迎える頃までには、そこまで行きたいですね。いま酵母でやっているのを、最終的には医療応用まで考えて、ヒトの細胞を対象にやっていきたいんですけど、それには電子顕微鏡そのものの技術革新がないと上手くいかないのではないかと思います。そこはぼくの領域を超えているので、専門家の皆さんにがんばっていただきたい」。
さらに、NIHの研究グループと共同で進めている『核内クロマチン構造解析に関する研究』については、「先ごろ、一定の成果を得られました。発表の段階に至るのが楽しみです」とほほ笑んだ。
※1.詳細はhttps://www.jstage.jst.go.jp/article/biophys/51/2/51_2_084/_pdf「NMRで観測する超高分子量タンパク質の分子形態」を参照
 2020年1月21日掲載
2020年1月21日掲載


