ゲノム編集技術を日本でいち早く導入。国内研究を大きくリードする存在に。
2020年10月、第3世代のゲノム編集技術「CRISPR-Cas9」を開発したエマニュエル・シャルパンティエ博士とジェニファー・ダウドナ博士にノーベル化学賞授与の報が世界を駆け巡った。ゲノム編集技術はいまや科学者の多くが利用できる身近な技術となっており、その将来性への期待は高まるばかりだ。折しも同年12月には日本発の「ゲノム編集食品」が日本国内で初承認されるに至った。ゲノム編集技術の応用分野は、こうした農畜水産物の品種改良をはじめ、バイオ燃料開発、創薬や遺伝子治療、実験に使われる疾患モデル細胞やモデル動物の作製など非常に幅広く、産学官での研究が世界中で推し進められているところだ。
そして、日本のゲノム編集技術研究はというと、他ならぬ広島大学を中心に進められてきた。その牽引役が分子遺伝学研究室の山本卓教授だ。⽶科学誌「ネイチャー・バイオテクノロジー」2019年10⽉号に掲載されたゲノム編集技術に関する論⽂数ランキングでは、同研究室の佐久間准教授が世界第5位、⼭本卓教授が世界第2位にランクされるなど、世界的にも名だたる存在であることは間違いない。

「ゲノム編集」とは、切断されたDNAの修復過程を利用して遺伝子を改変する技術だ。その基盤となるのは、ゲノム編集ツールとも呼ばれる「人工DNA切断酵素」であり、この「人工DNA切断酵素」の開発の歴史こそが、ゲノム編集技術開発の歴史と言える。
山本先生によれば、いわばハサミにあたる人工DNA切断酵素は、パソコンのOSに該当する基盤技術である。CRISPR-Cas9以前にも、第一世代と呼ばれる「ジンクフィンガーヌクレアーゼ(ZFN)」、第二世代と呼ばれる「TALEN」があり、それぞれ1996年と2010年頃に開発されている。
「ゲノム編集ではDNAを正確に切る酵素というのがまず使われたんですが、なかなか自在に特定の遺伝子だけを狙って切るハサミの酵素をつくるのは難しかったんですね。ZFNはうちの研究室でもつくれましたがかなり難しかった。そして、第二世代のTALENが発表されて、我々のところもそのTALENを改良した、よく切れるTALEN『プラチナTALEN』をつくって、それを使っています。そして第三世代のCRISPR-Cas9は、さらに簡便に使えて効率もよく、しかも基礎研究では安く使えるということで一気に広がりました。うちでもその改良ツールを開発しています」
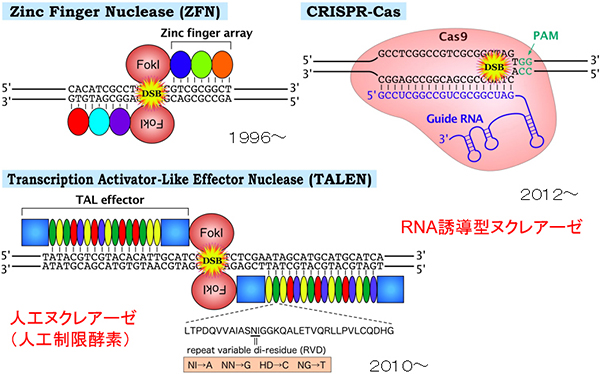 図1/ゲノム編集に利用される3種の人工DNA切断酵素
図1/ゲノム編集に利用される3種の人工DNA切断酵素
先生の研究室では、日本ではなかなか研究の進まなかったこの分野で、いち早くゲノム編集技術を導入した。しかも、他の研究グループは企業から購入する形での導入であったのに対し、2008年からZFNの作製システムを立ち上げ、2010年には最初の論文を発表している。取り組んできたのは、ウニ胚でのゲノム編集だ。
「元々わたしは発生生物学が専門でウニの研究をやっています。その中で、遺伝子の働きを光の強さで見たいと思ったんですね。そうした光を定量的に解析する技術というのは物理学者でないとできない。当時は広島大学の理学研究科数理分子生命理学専攻にいて、まわりには数学、化学、物理の研究者たちがいたので、何か一緒にできないかなと考えました。ウニの胚の中で遺伝子が働くようになると光るようにして、その光の強さを生きたまま顕微鏡でとらえることができれば、正確にその遺伝子の働きが分かる。生きた卵から形ができていく過程で、どんな遺伝子がどう働いているのかが分かるだろうと。そうした融合的な研究を進めるために、ゲノム編集がどうしても必要で、光る遺伝子をどうしても狙ったところに入れたかったというのがそもそものきっかけです」と山本先生。2008年当時、先生の研究室では、ZFNを使った標的遺伝子の切断によって蛍光遺伝子を挿入し、ウニの初期胚で骨をつくる遺伝子の発現をモニターすることに成功している。
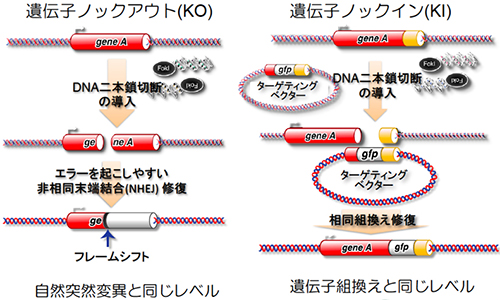 図2/人工DNA切断酵素を基盤とするゲノム編集技術
図2/人工DNA切断酵素を基盤とするゲノム編集技術
広島大学出身者が揃う研究室で、オリジナルのゲノム編集技術をいくつも開発。
以来、先生の研究グループでは、ウニの研究を続ける一方で、ゲノム編集技術そのものの研究にも挑み続け、さまざまな独自技術の開発に成功。発表された研究成果は主に次のようなものである(以下はごく一部。カッコ内は発表時期)。
- 高効率なゲノム編集ツール「プラチナTALEN」の開発とその作成システムの開発に成功(2013年11月)
- ゲノム編集技術を用いた簡便な遺伝子挿入法「PITCh法」を開発(2015年12月)
- ゲノム編集技術を改良し、狙い通りの改変結果が得られる確率を高める新技術「LoADシステム」を開発(2018年8月)
- ゲノム編集技術を応用し、遺伝子を高度に活性化する新技術「TREEシステム」を開発(2018年10月)
■PITCh法について
TALENやCRISPR-Cas9とMMEJ(マイクロホモロジー媒介末端結合)修復経路を利用した新たな遺伝子ノックイン法である。それまで一般的だった相同組換えに依存する方法に比べて、相同組換え活性の低い細胞種や生物種にも利用できるため、ゲノム編集技術の適用範囲を広げるとともに、簡便で高効率な手法として評価を集める。
■LoADシステムについて
Cas9と呼ばれるタンパク質がsgRNA(Single-guide RNA)と複合体を形成し、標的DNA配列を認識して切断する「CRISPR-Cas9」に改変を加え、ゲノムの標的部位に目的遺伝子を挿入するノックインの効率を大幅に向上。同時に3つの遺伝子座へ異なる蛍光レポーター遺伝子をノックインすることに成功した。複数の遺伝子のノックインを選択圧無しに導入できたCRISPR-Cas9の改変研究成果の発表は世界初。
■TREEシステムについて
「CRISPR-Cas9」に改変を加え、DNAの認識活性を残しつつ、切断活性を不活性化させるもの。同システムでは、DNA配列を切断したり書き換えたりすることなく、目的とする遺伝子の周辺に活性化タンパク質を高度に集積させることができ、従来技術よりも高い活性化効果を得ることができる。膵臓がん細胞において、がん抑制遺伝子の働きを従来の約30倍に高めることに成功。安全性の高いがん治療への応用が期待される。

ゲノム編集技術は、オープンイノベーションの仕組みが世界中で出来上がっており、基礎研究であれば誰もが自由に利用することができる。先生の研究グループが開発した技術も、Addgeneという米国のNPO法人を通じてマテリアルが世界中に配布されており、2016年にはその配布実績からBlue Flame Awardを佐久間准教授と共同で受賞。ゲノム編集技術の普及への貢献度についても高く評価されている。
先生の研究には大きく2つの特徴がある。ひとつは、常にゲノム編集の基盤的プロセスに介入したものであり、新しい技術の開発と確立を目指しているということ、もうひとつは、豊富な共同研究体制を敷いていることだ。2020年秋の時点で100以上もの共同研究が並行して動いているといい、同研究室の2名の准教授と講師の先生方が山本先生の脇をしっかり固め、共同研究の円滑な進行に尽力されていることは言うまでもない。
「うちの研究室だけで全部はできないので、必要な技術を持っている人たちに基礎研究を提供しつつ、共同研究で動かしていくというのがいまのスタイルです。ここまで成果を出せたのは佐久間准教授以下、多くのスタッフの皆さんの力があってこそ。ありがたいことに、わたしをはじめ、みんなが広島大学出身なんですよ」と顔をほころばせる。
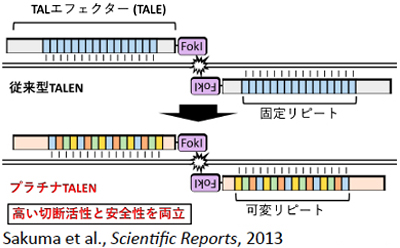 図3/広島大学開発のTALEN技術「プラチナTALEN」
図3/広島大学開発のTALEN技術「プラチナTALEN」広島大学が開発したプラチナTALENは、非常に高い切断活性を有し、多くの生物の遺伝子ノックアウトに利用されている
未来を見据えた研究開発と社会実装に砕身。最先端の技術を広島から発信。
こうした研究開発と並行して、先生が力を入れているのが、ゲノム編集技術の「社会実装」だ。
「日本のゲノム編集技術開発は世界に随分遅れを取っているんですよ。およそ2周遅れぐらいなので、なんとか巻き返しを図りたいとずっと思っています。そのためには、産業界も一緒になって、オールジャパンで研究を進めなければ」と先生。そうした思いのもと、さまざまな連携や組織が生まれていく。
最初に生まれたのが「ゲノム編集コンソーシアム」(2012年)だ。これは、ゲノム編集技術がさまざまな基礎研究に利用できることが分かると、自分が使っている実験生物にそれを応用したいという話が多くの研究者から寄せられたことから生まれたコミュニティである。
さらに、2016年には「ゲノム編集学会」を立ち上げる。
「これからは、研究はもちろん企業の開発分野でも、ゲノム編集技術を使わないと勝てない。そこで、産業でも利用できるようにしたい、企業さんたちに情報提供できる場をつくりたいといった思いから、ゲノム編集技術を社会実装できる流れをつくるための組織『ゲノム編集学会』をつくりました」
同じ頃、「ゲノム編集による革新的な有用細胞・生物作成技術の創出」という研究領域がJST(科学技術振興機構)の「研究成果展開事業 産学共創プラットフォーム共同研究推進プログラム(OPERA)」に採択される。これは、2014年に生まれた広島大学の「ゲノム編集研究拠点」を核として、大学・企業等が連携して産学共創プラットフォームを形成し、バイオ産業、ライフサイエンスなどの分野で革新的な価値創造が見込まれるゲノム編集技術の社会実装に向けた基盤づくりをおこなうもの。現在、11の研究機関と23社ほどの企業が一体となってさまざまな開発研究がおこなわれている(2016年度より6年間)。
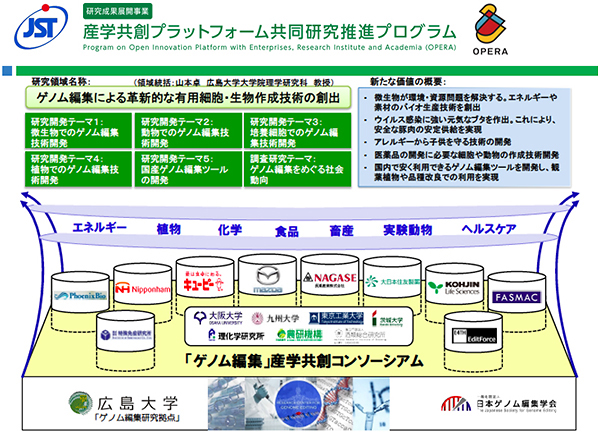 図4/産学共創プラットフォーム共同研究推進プログラム
図4/産学共創プラットフォーム共同研究推進プログラム
そして、2019年2月には、産学官連携の取り組み推進拠点として、広島大学イノベーションプラザ内に「広島大学ゲノム編集イノベーションセンター」が開設される。
上記のいずれの組織も山本先生がトップとなって運営されているというから、そのバイタリティには驚くばかりだ。加えて2019年8月には、共同研究で寄せられるニーズに応えるため、プラチナTALENを使ってつくった細胞や動物を製品として売り出すベンチャー企業「プラチナバイオ社」を設立。産業利用に最適なゲノム編集技術の提供とともに、社会実装に必要な安全評価や知財戦略等のコンサルティング業務、バイオ×デジタル人材の育成にも努めている。
研究に、仕組みづくりにと、さまざまな組織や人々とともに活動を続ける山本先生。何が先生を動かすのか――。
そこには、発見や創造の喜び、世の中への貢献といった意識のほか、前述の巻き返しへの意欲、さらには後身育成への想いもあるという。
「新しい研究をどんどん進められるような仕組みをつくらないといけないというのと同時に、若い研究者に、こういう研究をしてればこういう問題の解決につながるということを具体的に示すことで、モチベーションをあげていくことが、いまの時代では特に必要だと思います」と先生。
 図5/広島大学 ゲノム編集イノベーションセンターの設置概要と持続可能な取り組み
図5/広島大学 ゲノム編集イノベーションセンターの設置概要と持続可能な取り組み
そして、「CRISPR-Cas9の唯一の欠点は特許利用料が非常に高額なこと。製薬に使おうとすると一時金だけで100億円もかかる。とても使えないので、基礎研究ではCRISPR-Cas9を使いながら、商業利用ではZFNやTALENを使った国産のツールを利用するといったようなやり方を考えています。さらに、企業の商業利用の支援をしたり、こうした分野で起業したい人や地方創生にも役立つような支援拠点をつくりたい。それが、定年を迎えるまでのここ10年のうちにやるべきことだと思うんですよね」と使命感もにじませる。
いまはまだ安全性や倫理面など多くの課題をはらむゲノム編集技術だが、今後はどのように進展していくのだろうか。山本先生は「必ず使わざるを得ない技術になります」と断言。iPS細胞やAIなどを活用することで、食糧問題など人類が抱える諸問題の解決に役立てられるのはもちろんのこと、いずれは人工生命体の開発にも向かうのではないかと予測する。
「日本は海外とは研究費のスケールが違うのでスピードではまったく勝てないんです。でも、まだまだ勝ち目はあります。夢は大きいですよ。未来に向けて新しいバイオサイエンスの技術開発を広島からやりたいと思っています」
 2021年3月3日掲載
2021年3月3日掲載


