注目を集めるゲノム編集ツールをより使いやすく、効率よく発展させる。
2020年のノーベル化学賞に、第3世代のゲノム編集技術である「CRISPR-Cas9」を開発したエマニュエル・シャルパンティエ博士とジェニファー・ダウドナ博士が選ばれたことは記憶に新しい。その受賞は、「ゲノム編集技術」の開発がいかに価値のあるものであるかを物語るものであり、同分野の研究者である佐久間先生にとっても、非常に喜ばしいニュースであった。
「ゲノム編集」とは、DNAを切断するハサミに相当する酵素を利用して、生物の設計図であるゲノムDNAを切断し、書き換える技術である。ゲノムDNAには、たとえばヒトの場合、文字に置き換えるとおよそ30億文字にのぼる膨大な情報が含まれており、その中から特定の遺伝子の情報だけをピンポイントで書き換えるのは、不可能に近いこととされてきた。「ゲノム編集によってそれが可能になり、基礎生物学から医学、歯学、薬学、農学、水産学、畜産学など、生命科学が関係するあらゆる分野においてパラダイムシフトを引き起こしました。生物の設計図を書き換えることができれば、生物の性質を変化させることができるので、アイデア次第で応用の可能性は無限にあります」と先生は言う。

先生によれば、ゲノム編集技術開発の歴史は次のようなものだ。
「最初にゲノム編集のベースになるようなコンセプトが発見されたのが1990年前後。その後、1996年に第一世代のツールと言える『ジンクフィンガーヌクレアーゼ(ZFN)』が開発され、2010年頃にようやく第二世代のツール『TALEN』が発表されました。そして、2012年に開発されたのが前述の『CRISPR-Cas9』ということになります。先の2つは人工酵素と呼ばれるもので、自然界にないタンパク質を作り上げてDNAのハサミを作っているのに対して、CRISPR-Cas9はもともと自然界に備わっているタンパク質をそのまま使っている。自然界の仕組みをうまく利用して、狙ったところを切れるように使っているため、非常に使いやすくて効率も良い、画期的なツールと言えます」。
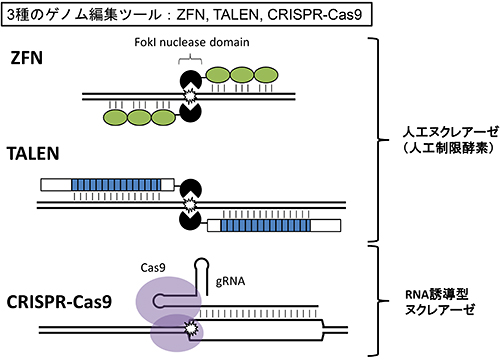 図1/3種のゲノム編集ツール
図1/3種のゲノム編集ツール
佐久間先生が現在の研究をスタートさせたのは、2010年に入学した博士課程後期のこと。当時から変わらず所属しているのは、山本卓教授が主宰する分子遺伝学研究室である。同研究室は、国内のゲノム編集技術開発を牽引するトップラボのひとつとして名を馳せる。
先生の研究グループでは、国内外での共同研究を積極的に進めており、その成果を続々と発表。英科学誌「ネイチャー・バイオテクノロジー」2019年10月号に掲載されたゲノム編集技術に関する論文数ランキングでは、佐久間先生が世界第5位、山本卓教授が世界第2位にランクされている。
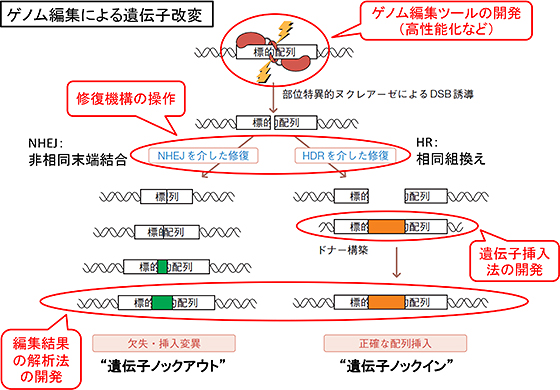 図2/ゲノム編集による遺伝子改変の仕組みと技術開発
図2/ゲノム編集による遺伝子改変の仕組みと技術開発
オンリーワンの技術よりも汎用性の高い技術開発を目指す研究スタイル。
発表された研究成果にはどのようなものがあるのか、以下にごく一部を挙げる(カッコ内は発表時期)。
- 高効率なゲノム編集ツール「プラチナTALEN」とその作製システムの開発に成功(2013年11月)
- ゲノム編集技術を用いた簡便な遺伝子挿入法「PITCh法」を開発(2014年11月)
- ゲノム編集技術を改良し、狙い通りの改変結果が得られる確率を高める新技術「LoADシステム」を開発(2018年8月)
- ゲノム編集技術を応用し、遺伝子を高度に活性化する新技術「TREEシステム」を開発(2018年10月)
このうち「プラチナTALEN」は佐久間先生が筆頭著者となって、「PITCh法」、「LoADシステム」、および「TREEシステム」は佐久間先生が責任著者となって、それぞれ開発、論文発表をおこなったものである。最新成果である「LoADシステム」と「TREEシステム」の概要は次のようなものだ。
■LoADシステムについて
Cas9と呼ばれるタンパク質がsgRNA(Single-guide RNA)と複合体を形成し、標的DNA配列を認識して切断する「CRISPR-Cas9」に改変を加え、ゲノムの標的部位に目的遺伝子を挿入するノックインの効率を大幅に向上。同時に3つの遺伝子座へ異なる蛍光レポーター遺伝子をノックインすることに成功した。複数の遺伝子のノックインを選択圧無しに導入できたCRISPR-Cas9の改変研究成果の発表は世界初。
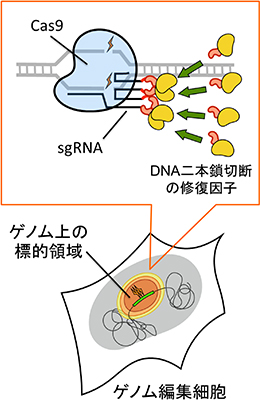 図3/LoADシステム模式図
図3/LoADシステム模式図
■TREEシステムについて
「CRISPR-Cas9」に改変を加え、DNAの認識活性を残しつつ、切断活性を不活性化させたものを使用する。同システムでは、DNA配列を切断したり書き換えたりすることなく、目的とする遺伝子の周辺に活性化タンパク質を高度に集積させることができ、従来技術よりも高い活性化効果を得ることができる。膵臓がん細胞において、がん抑制遺伝子の働きを従来の約30倍に高めることに成功。安全性の高いがん治療への応用が期待される。
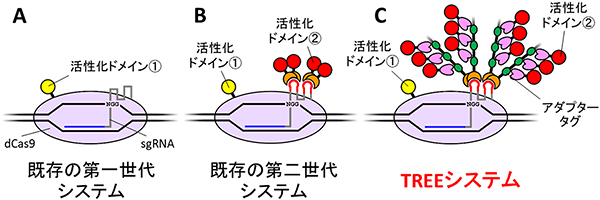 図4/既存の遺伝子活性化システム(第一世代・第二世代)とTREEシステムの模式図
図4/既存の遺伝子活性化システム(第一世代・第二世代)とTREEシステムの模式図
佐久間先生の研究目標は、技術をより使いやすくしたり、技術の幅を広げたりすることで、技術を発展させると共に、応用を促進することであるという。「いくら高性能な技術を開発しても、それが限定的な用途でしか使えないものであったり、高度な技能を必要とする職人芸のような技術であったりすれば、結局のところ広く利用されるには至りません。私のモットーは、真に“使える”技術を開発することであり、その信条に基づいて扱いやすい技術を開発してきたからこそ、数多くの共同研究に繋がっていると考えています」と先生。つまり、『オンリーワンの技術を作ることではなく、むしろなるべく汎用的に利用できる技術を開発すること』こそがモチベーションなのである。
そのため、先生の研究グループが開発した技術は、アカデミアで自由に使用できるよう、Addgeneという米国のNPO法人を通じてマテリアルを世界中に配布されている。2016年には、その配布実績からBlue Flame Awardを山本教授と共同で受賞するなど、そのゲノム編集技術の普及に努める姿勢は、研究業績とともに、高く評価されている。

開発した技術が世に広がっていくおもしろさ。最先端の研究ならではの醍醐味。
いまをときめくゲノム編集技術の研究に携わることは、どれほどの興奮をもたらすものなのか、佐久間先生に聞いてみた。すると、「最前線で研究開発を進めることはとても刺激的」と先生。しかしそこには、「時として自分が考えもつかなかったような大きなブレイクスルーを生む技術が開発されて深い感銘を受けたり、自分たちが開発を進めていたものと同じ技術が海外のグループから先に報告されて悔しい思いをしたり」とさまざまな局面もあるとのこと。さらに、「ゲノム編集技術の進歩はすさまじく、新しい技術や用途、応用展開が、生命科学史上類を見ないスピードで世界中から報告されており、その勢いは今も加速し続けています」とも語り、「常に最新動向にアンテナを張りながら研究を進めていく必要があります」との覚悟もにじませる。
それでも研究を続けていくのは、「自分が開発した技術がいろいろな形で活用され、世に広がっていく」おもしろさを知っているからだ。「『プラチナTALEN』は、適用された生物種だけを挙げても、ヒト細胞からマウス、ラット、ブタ、マーモセット、カエル、イモリ、マグロ、メダカ、ゼブラフィッシュ、ウニ、ホヤ、カイコ、線虫、更には植物や微細藻類・麹菌などの微生物に至るまで、文字通り多種多様です。用途についても、細胞生物学や発生生物学などの基礎生物学分野の研究はもちろん、治療用細胞の作製から農水畜産物の品種改良、バイオ燃料などの物質生産等々多岐に渡ります。このような異分野の研究者の方々との共同研究を通して、自分たちが生み出した技術が大きく羽ばたいていくのを実感できることは、研究者として至上の喜びです」。

また、研究に際して大切にしていることは、「バランス感覚」であるとのこと。
「我々自身の基礎技術開発と、共同研究での応用開発のバランスをはじめ、挑戦的な研究と堅実な研究のバランスや、学術的価値の高い研究と産業的価値の高い研究のバランスも重要です。リソースは有限なので、どこにどれだけの人的・資金的・時間的リソースをつぎ込むかは、研究者のセンスと手腕が問われるところです」と先生。近年は、教育および学会での活動の他に、入試業務や学内委員としての業務、アウトリーチ活動など研究以外の業務が急増し、「適切なバランス感覚がなければ、実際問題として研究が行えない状況」にあり、論文の発表数が減少傾向にあることが悩ましいところだ。
「一人の研究者の限られたリソースを、最大限の学術的・社会的貢献に資すること」を目指す姿勢はこれからも変わらないと言い、今後も海外の開発者と切磋琢磨しながら研究開発を続けていくという佐久間先生。今後達成を目指していくことのひとつに「実際の医療や産業への応用」があるという。
「現在は応用といっても研究開発段階の域を出ませんが、近い将来、自分たちの技術に基づくゲノム編集を施した治療用細胞が実際の医療に使われたり、きちんとした安全性評価や社会受容のステップを経たうえで、真に安全かつ有益なゲノム編集食品がマーケットに出たりする未来が訪れることを期待しています。私は山本教授をCTOとして設立されたプラチナバイオ株式会社の科学技術顧問も務めており、今後ますます活発になるであろうアカデミアと産業界との橋渡しにも精力的に関わっていきたいと考えています」。
 2021年1月13日掲載
2021年1月13日掲載


