分裂酵母を用いたテロメア研究で世界初の機能解明に成功。
上野先生が研究するのは染色体である。染色体には、分からないことがいまだ多く残されている。
- 長さ2mのDNAが6μm(マイクロメートル)の細胞核に収まって、どうしてもつれないのか?
- 約2万個の遺伝子のうち、それぞれの細胞内で特定の遺伝子しか機能しない機構は?
- DNA複製のエラーは60億塩基対に6回。なぜそんなに正確なのか?
- 92本の染色体が46本ずつ均等に分配される機構は?
- 細胞はどのようにDNA損傷を認識し、修復するのか?
こうした染色体の神秘に惹かれた先生は、さまざまな角度からこれらの解明に挑んでいる。
なかでも、先生が注目するのは「テロメア」だ。テロメアとは、染色体末端に存在する繰り返しDNA配列(テロメアDNA)とそれに結合するタンパク質から構成される大きな複合体のこと。テロメアは、細胞分裂のたびに短くなり、長さが限界に達すると細胞は分裂を停止し老化する。しかし、細胞が分裂を続けると、染色体の末端がダメージを受け、末端を維持するために細胞ががん化するということが分かっている。このように、テロメアDNAの長さは老化やがんと密接に関係することから、テロメアの研究は老化やがんの制御に応用できる可能性があるという。
「がんの主な原因は染色体の異常です。がん細胞を正常細胞と比べてみると、染色体の数が違ったり、異なる染色体同士がつながったり切れるなど、大変不安定になっている。染色体を安定に保つことができれば、がんの防止につながります」と上野先生。


また、老化については、細胞核内に収まっている核小体や核膜の働きにも関心を寄せる。
「早老症のひとの核膜は大きく変形していたり、核小体が健康なひとよりも早いスピードで大きくなるということが分かっています。こうしたことから、核膜や核小体は人間の健康に大きく関わっていると言えるのですが、染色体の機能においてどのような役割を果たしているのかということはまだ全然分かっていないんです」。
上野先生がテロメアの研究を開始したのは1997 年のこと。当時報告されていた分裂酵母のテロメア関連タンパク質は、二本鎖テロメアDNA に結合するTaz1(ヒトTRF1 とTRF2 の相同タンパク質)のみだったため、テロメアで機能する分裂酵母の新規タンパク質の探索とその機能解析に取り組むこととし、特にDNA 複製、組換え、修復などに関与するヌクレアーゼMre11 やヘリケースDna2、塩基配列非特異的一本鎖DNA 結合タンパク質RPAなどがテロメアで機能するかどうかを世界に先駆けて解析した。
その結果、以下のような新事実を発見した。
- taz1 破壊株はMre11 依存的にテロメア一本鎖突出※が形成される
- DNA 複製に必要な蛋白質Dna2 がテロメア末端の一本鎖突出形成に必要である
- DNA 複製因子であるrpa とtaz1 の二重変異株はテロメアDNA が急激に消失するが、そのテロメア消失はPot1 の過剰発現によって抑圧される
こうした研究成果はその後、世界トップレベルの雑誌であるMolecular Cell Biology 2報とMolecular Biology of the Cell 1報に発表され、高い評価を集めるとともに、上野先生はその功績によって、2008年度日本農芸化学会奨励賞受賞の栄に浴している。
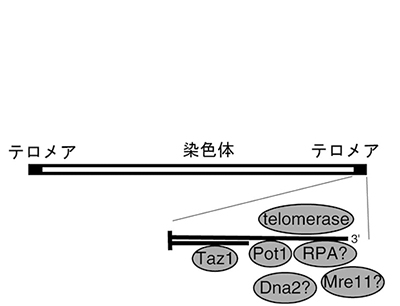 図1 /テロメアと分裂酵母テロメア結合タンパク質分裂酵母では、染色体の末端に(GGTTACA)n の繰り返し配列(テロメアDNA)がほぼ規則的に約300塩基存在する。Taz1
は二本鎖テロメアDNA に、Pot1は一本鎖テロメアDNA に特異的に結合する。RPA は一本鎖非特異的DNA 結合タンパク質、Mre11 はDNA修復に関係するヌクレアーゼ、Dna2
はDNA 修復に関するヘリケースで、これらのタンパク質がテロメアで機能するかどうかは分かっていなかった。Telomerase(テロメラーゼ)はテロメアDNA
を伸長する酵素を含んだRNA タンパク質複合体
図1 /テロメアと分裂酵母テロメア結合タンパク質分裂酵母では、染色体の末端に(GGTTACA)n の繰り返し配列(テロメアDNA)がほぼ規則的に約300塩基存在する。Taz1
は二本鎖テロメアDNA に、Pot1は一本鎖テロメアDNA に特異的に結合する。RPA は一本鎖非特異的DNA 結合タンパク質、Mre11 はDNA修復に関係するヌクレアーゼ、Dna2
はDNA 修復に関するヘリケースで、これらのタンパク質がテロメアで機能するかどうかは分かっていなかった。Telomerase(テロメラーゼ)はテロメアDNA
を伸長する酵素を含んだRNA タンパク質複合体
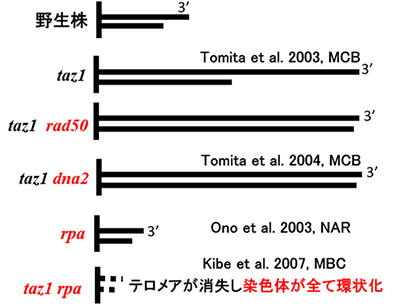 図2 /上野グループが明らかにした分裂酵母のDNA修復、複製因子のテロメアにおける表現型。染色体末端のテロメアDNA 部分のみを直線で示した
図2 /上野グループが明らかにした分裂酵母のDNA修復、複製因子のテロメアにおける表現型。染色体末端のテロメアDNA 部分のみを直線で示した※「一本鎖突出」…テロメアDNAは、二本鎖部分と末端の一本鎖部分からなり、一本鎖部分はDNAの3’末端側が突出している。3’末端とは、OH基の付いたデオキシリボースの3’位の炭素が向いている側。
がんや遺伝病と関連性のある環状染色体に関する新発見を続々と。
新たな発見はその後も続く。上野先生とそのグループは、染色体研究の過程で、ある遺伝子が機能しないとテロメアが短くなり、その後、染色体の末端同士がくっついて丸くなる、いわゆる『環状染色体』が形成されることを発見した。『環状染色体』の発現自体はすでに見つかっていたが、関与する遺伝子を特定したのは世界初のことであった。
これを機に、上野先生は環状染色体の研究も開始する。
「ヒトの細胞でも環状染色体は見つかっていて、特に、隆起性皮膚繊維肉腫などのがんでは約7
割が、高分化型脂肪肉腫では85%が環状染色体を持つということが分かっています。ということは、環状染色体を持った細胞だけを殺すことができたら、がん細胞を殺すことができるのではないかと考えまして、環状染色体の特徴について、詳しく研究するようになりました」。
するとその後、先生のグループでは、環状染色体になるような酵母を使って、環状染色体を持った酵母の弱点を探るようになり、その過程で、『染色体パッセンジャー複合体』というタンパク質が環状染色体の維持に必要であるということを発見する。この発見は、2018年1月の広島大学のプレスリリースに取り上げられたほか、米国科学誌 「PLOS ONE」オンライン版にも掲載された。現在、環状染色体についてここまで深く研究している研究者は、世界でも上野先生ただ一人である。
先生の研究はさらに進展中だ。
染色体研究によるがん治療への応用研究に関しては、酵母の遺伝子改変によってがんの特徴を持たせた酵母を作成し、その酵母の弱点を探すことで、がん細胞の新しい弱点を見つける研究をおこなっているとのこと。
この研究は、2012 年に文部科学省に採択された事業により、広島大学に設置された『広島大学
核内クロマチン・ライブダイナミクスの数理研究拠点』の枠組みの中で進められているもので、上野先生もそのメンバーのひとり。
ここでは、さまざまな融合領域研究が実現していることから、今後の研究の進展が大いに楽しみである。
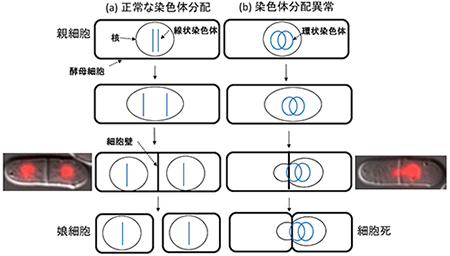
(b)環状染色体を持つ(がん細胞と似た特徴を持たせた)酵母細胞で、染色体パッセンジャー複合体の機能が少し低下した細胞では、環状線色体の分配が正常に行われず、染色体が均等に分配されない状態で、細胞壁が形成される。その結果、細胞が正常に分裂できず死滅する。染色体パッセンジャー複合体の機能が少し低下した場合でも、線状染色体が正常に分配される酵母の顕微鏡写真(図左端)と、染色体パッセンジャー複合体の機能が少し低下したことで環状染色体が正常に分配されない時の酵母の顕微鏡写真(図右端)を、それぞれ図の左端と右端に示した。核に存在するタンパク質に赤い蛍光タンパク質をつなぐことで核を可視化した

分裂酵母での発見をヒト細胞にも。染色体と生活習慣との関連に関する情報発信も。
先生の研究で特徴的なのは、ヒトと仕組みが似ている分裂酵母という単細胞生物を使って染色体の研究を行い、その研究で見つけたことをヒトの細胞を用いて検証するという方式を取っている点だ。「そうすることで、短期間に新しいことを発見することができるとともに、修士課程の学生が一から実験を始めても短期間で実験手法が習得でき、うまくいけば2年間で論文1報が書けるくらいの研究結果が得られる」と先生は言う。
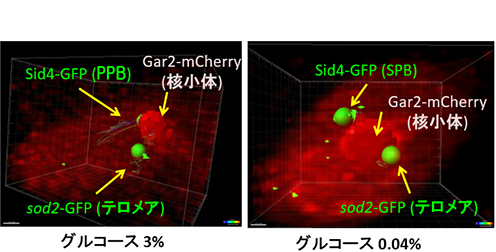
一方で、染色体に関する基礎研究では、前述のように、数理分子生命プログラムの先生方の協力のもと、染色体や核内の分子の動きや位置を数学的な手法を使って詳細に解析している点にも特徴がある。「スピニングディスク蛍光顕微鏡という最先端の機器を活用したり、数学的な解析を加えることによって、これまで生物学者が見つけられなかったような、新しい生命現象が見つかりつつあります」。
根本には、生命の基本原理を知りたいという関心と、がんの治療に貢献したいという思いが、同じくらいのウエイトで存在するという上野先生。今後は、どのような展望を抱いているのだろうか。
「染色体の動きや空間配置を定量解析することで、これまで発見されていない新しい生命現象を発見したいですね。また、がん細胞の特徴を持たせた酵母を使って、がんの弱点を発見したい。さらに、染色体を標的にした新しい薬物の発見やその作用機構の解明をおこないたいです」。

こんな話も続けてくれた。「染色体の研究をしていると、生活習慣が如何に重要かがわかります。例えば、精神的ストレスであるとか、タバコやお酒の飲み過ぎは、テロメアや染色体にダメージを与えます。一方、適度な運動は、テロメアの保護やがんの予防に効果的です。そこで、生活習慣と染色体、テロメアの関係について、社会にわかりやすく発信して行きたいと思います」。
現在も、市民講座などを開いて、そうした情報発信にも努めているとのこと。しかし、「大事だと分かっていても、なかなか実行できないものなので、何度も伝えることで、その重要性を分かってもらえるようにしていきたい」と力を込める。
そして、「わたしたちが分裂酵母で見つけたことが、ヒトの細胞でも同様になっていたら、もっとすごいですよね。それをいま研究しているところです」と先生。
人類にとって、待望の大発見が発表される日も、そう遠くない未来にありそうだ。
 スピニングディスク蛍光顕微鏡
スピニングディスク蛍光顕微鏡
 クロマチン動態の定量解析による染色体制御機構の解明
クロマチン動態の定量解析による染色体制御機構の解明
 2020年1月21日掲載
2020年1月21日掲載


